珍藏!IND注册登记业务流程及数据资料明确要求(附详尽业务时序)
作者:药智网/毛萼svt
随著我国重新加入ICH,我省愈来愈多的创该药参予到亚洲地区合作开发。且随著近几年我省引导技术创新研制经济政策唤起,我国创该药研制势能已经开始快速释放出来。
IND注册登记业务流程
该药科学研究挂牌上市主业务流程
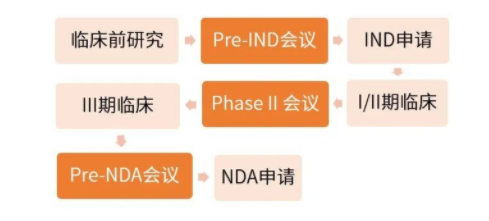
Pre-IND全会
01沟通会全会进行分类:
I类:
抗生素临床实验操作过程中碰到的关键性可靠性难题;
其它明确规定情况。
II类:
该药临床实验提出申请前全会;
抗生素Ⅱ期临床实验完结/Ⅲ期临床实验开启前全会;
该药挂牌上市许可提出申请前全会;
风险评估和控制全会。
III类:
02提出申请沟通会全会业务流程:
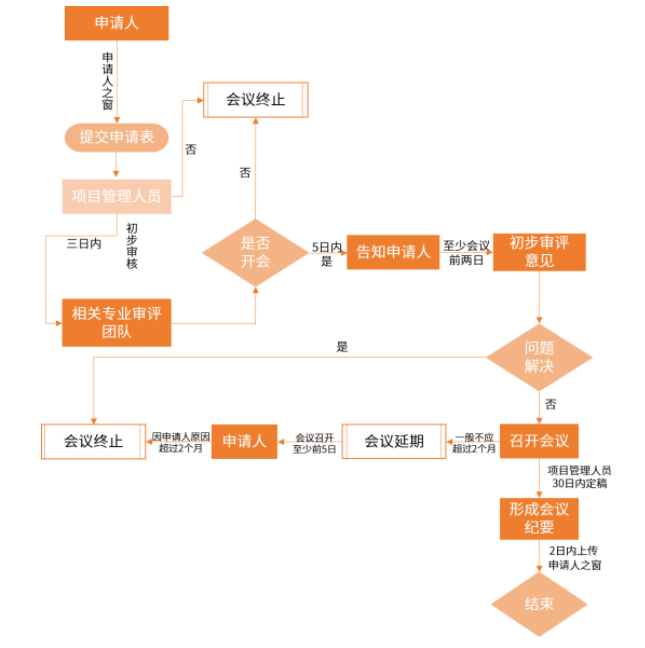
※注:从提出申请人提出申请到召开全会,I类全会需要在30日内,II类全会需60日内,III类全会需75日内开展。
IND受理与审评审批业务流程
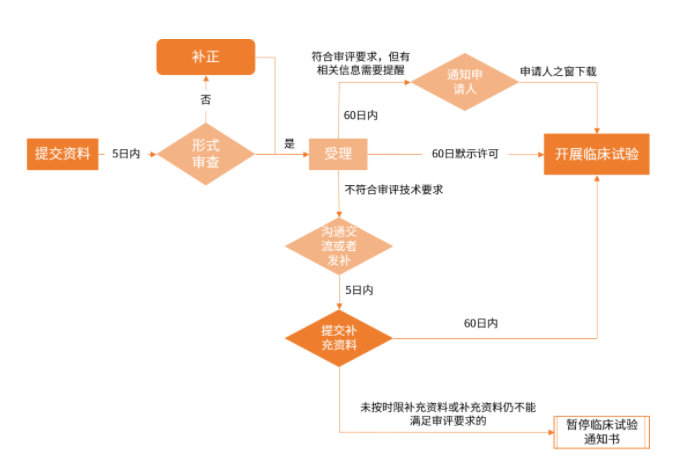

介绍性说明和总体科学研究计划
01介绍性说明:
02总体科学研究计划:
科学研究者手册
临床实验方案
药学科学研究信息
该药化学结构或制剂辅料具有已知毒性或极可能具有毒性;
在计划实施的整个I期临床实验项目期间,该药不能保持稳定性;
主细胞库或工作细胞库未经过充分鉴定。
非临床科学研究信息
药理学科学研究的总结:体内外药理作用及其作用机制、次要药效学信息、药效与暴露关系的科学研究信息;
各项科学研究报告:提供已经获得的药理作用、毒理科学研究和药代动力学的各项科学研究报告;
其它。
既往临床使用经验说明
如果有既往的临床使用经验,提出申请人应提供相关信息概述;
 深圳小产权房网
深圳小产权房网



![业主出售:[龙华 民治] 梅龙大道43号【惠鑫公寓】一房](https://www.fang85.com/d/file/szesf/2023-06-06/d4a73676cf33df16671c53d8889e7363.png)





